一、2022年度检查概况
2022年度上海市器审中心依据《医疗器械生产质量管理规范》(以下简称规范)对有源类医疗器械生产企业(设备类,不含独立软件产品)开展了现场体系核查,涉及核查产品为185个。
二、不符合项分布情况
通过分析现场核查不符合项发现,127家次现场体系核查合计发现缺陷835项,其中关键不符合项254项,一般不符合项581项。
从不符合项在《规范》中各章节的分布情况来看,规范的11个章节均有涉及。从各章节不符合项总数占比来看,占据前四位的分别为设计开发(27%)、生产管理(18.5%)、质量管理(17.3%)和采购(15.7%)。不符合项分布情况详见图一。
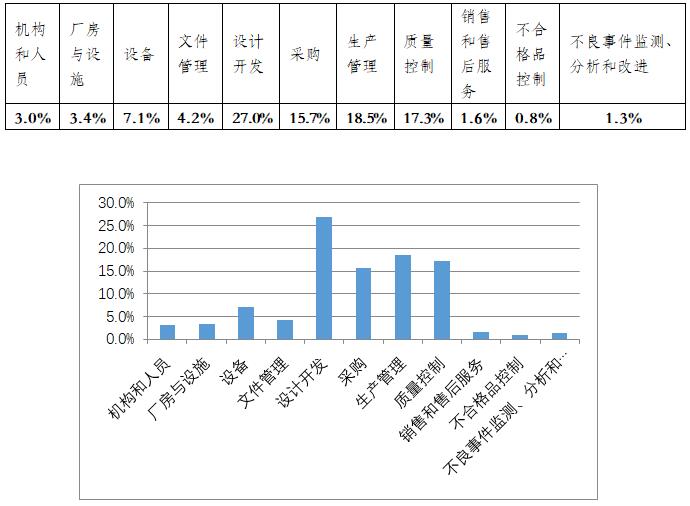
图一不符合项分布情况
三、现场核查常见问题
从2022年度有源医疗器械的现场核查发现的不符合项中出现问题最多的4个规范章节进行梳理:
(一)设计开发
现场检查发现设计过程控制存在不足,主要体现在以下几方面:(1)注册人委托生产企业进行生产时,委托协议中双方对研发的职责不明确,注册人和受托生产企业对设计文件的转移不充分。(2)设计开发研发过程和输出资料缺失。如现场未查见主控板的元器件、BOM清单、技术图纸、主板电路原理图、软件源代码等技术研发资料,或与实际生产样机、产品说明书存在不一致。(3)设计验证不充分。如缺少对产品主要性能参数或与外部配合使用器械的验证及相关记录,产品部分功能未在技术要求中提及,未完成相关验证。(4)设计变更未进行及时的识别、评审、验证和确认。(5)产品风险分析及控制措施评价不充分,如产品开发新功能时未充分考虑临床使用过程中的风险,未考虑产品故障情况下的非预期使用可能产生的风险。
(二)采购管理
现场检查主要发现采购质量协议中未明确采购要求、主要部件未能满足采购追溯等问题,主要体现在以下几方面:(1)采购质量协议或采购合同中对主要采购部件的材质、性能、技术参数、质量标准等方面未做明确要求。(2)原材料的进货检验规范或验证内容浮于表面,仅对外观、尺寸提出要求,未覆盖关键性能参数,与技术要求中整机性能参数有冲突。(3)涉及软件委外研发时,开发协议中未明确软件需求、交付技术文件内容、验收标准、软件更新及维护等内容。(4)关键部件未能追溯到供方的批号,对原材料批量问题无法开展分析和追溯。
(三)生产控制
现场检查发现生产工艺不充分或关键控制点不明确、生产记录不完整、主要零/部件无法追溯等问题,主要体现在以下几方面:(1)部分企业存在生产过程简单的问题,未对产品生产工序进行合理、有效分解细化,过度依赖部件模块化。(2)未对调试等关键工序制定详细的作业指导书,存在依据经验进行生产的情况。(3)生产过程未按照作业指导书中的要求执行,生产记录简单,未记录关键部件序列号或编号、软件完整版本号,无法满足可追溯的要求。
(四)质量管控
现场检查发现检验规程不充分、检验记录不完整、检验过程无法追溯等问题,主要体现在以下几方面:(1)对检验规程未能覆盖产品技术要求的检验项目,也未采取抽检或过程控制等有效的质量管控方式。(2)检验方法与产品技术要求或国家标准有区别时,企业未对所采用的方法进行科学有效的确认,未能提供上述不同方法的等同性说明。(3)检验记录缺少原始数值记录,检验结果无法重现或追溯。(4)对于检验条件和设备要求较高,企业不具备检验能力的,也未委托具有资质的机构进行检验,以证明产品符合强制性标准和经注册的产品技术要求。(5)产品分别存在使用模式和检验模式的情况下,未对检验用软件进行充分确认。
|

