1.年度检查概况
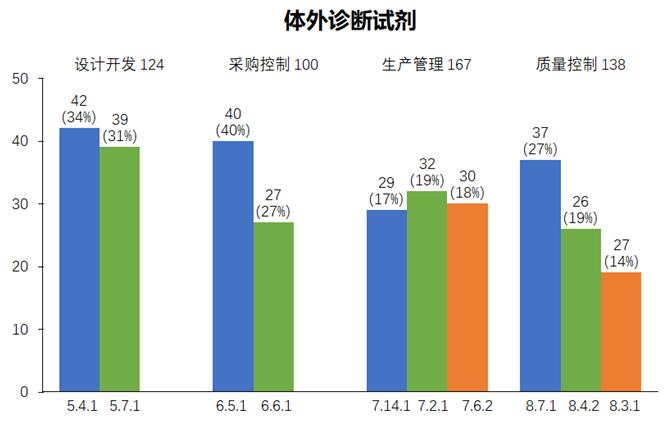
2023年度,本中心依据《医疗器械生产质量管理规范》和《医疗器械生产质量管理规范附录体外诊断试剂》对体外诊断试剂企业依申请开展现场核查,合计发现不符合项共666项次。从不符合项在《规范》中各章节的分布情况来看,设计开发(124项次)、采购控制(100项次)、生产管理(167项次)、质量控制(138项次)占比近八成。
2. 现场核查常见问题
下面将从设计开发、采购控制、生产管理、质量控制四个方面对体外诊断试剂产品的常见核查问题进行梳理分析。
2.1设计开发
在设计开发方面,常见问题主要集中在条款*5.4.1和5.7.1。
*5.4.1设计和开发输出应当满足输入要求,包括采购、生产和服务所需的相关信息,产品技术要求等。
(1)输出不完整。
如工艺配方中投料量计算公式不完整;说明书中未明确样本采样管的类型;全血样本未明确的抗凝剂种类;未明确样本稀释液种类。
(2)输出内容不一致。
如产品技术要求和标准操作规程中对抗原母液浓度标定的选用方法不一致。
5.7.1应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录。
(3)验证缺失、不完整。
如未验证说明书中标识所用全部样本类型;对校准品的适用机型验证未覆盖说明书中全部机型;验证用样本非说明书适用样本类型。
2.2采购控制
在采购控制方面,常见问题主要集中在条款6.5.1和6.6.1。
6.5.1采购时应当明确采购信息,清晰表述采购要求,包括采购物品类别、验收准则、规格型号、规程、图样等内容。
(1)质量协议或采购要求内容不完整。
如抗原抗体类原材料未明确生物学来源及克隆号信息;未明确抗体类型、生产厂家、纯度等信息。
(2)采购要求和产品技术要求等文件的规定不一致。
如引物探针类原材料验收标准和采购要求不一致。
6.6.1应当对采购物品进行检验或验证,确保满足生产要求。
(3)进货检验记录不完整。
如未记录检验用设备和试剂信息;未记录原始检测值,无法体现检测过程。
2.3生产管理
在生产管理方面,常见问题主要集中在条款*7.2.1、7.14.1和7.6.2。
*7.2.1 应当编制生产工艺规程、作业指导书等,明确关键工序和特殊过程。
(1)工艺作业指导书未明确某些工艺参数。
如冻干作业指导书未明确温度、时间和真空度等参数;未明确引物原料的投料浓度。
(2)对关键工序和特殊过程的重要参数缺少验证或确认。
如未对烘干箱和干燥箱的最大干燥数量进行验证。
7.14.1 应当按照物料的性状和储存要求进行分类存放管理,应当明确规定中间品的储存条件和期限。
(3)未规定中间品的储存条件、效期,或未按规定执行。
如未规定中间品冻融次数要求;实际生产使用了超过有效期的中间品。
7.6.2 生产记录应当包括:产品名称、规格型号、原材料批号、生产批号或生产编号、生产日期、数量、主要设备、工艺参数、操作人员等内容。
(4)生产记录信息不完整,不满足可追溯要求。
如溶液配制记录未正确记录配制物料名称与数量;未按工艺规程要求记录稳定时间与平衡时间及各阶段产出的产物的数量;未记录设备编号。
2.4质量控制
在质量控制方面,常见问题主要集中在条款*8.3.1、8.4.2和8.7.1。
*8.3.1应当根据强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程,并出具相应的检验报告或证书。
(1)检验规程缺失具体的检测项目,或检验规则不完整,不能有效指导操作。
如检测项目未覆盖强制性标准和产品技术要求;未制定批间差、稳定性项目的检验规则。
(2)未按规程执行检验。
如未按规定频次实施检测;未按规定数量进行测试。
8.4.2检验记录应当包括进货检验、过程检验和成品检验的检验记录、检验报告或证书等。
(3)检验记录信息不完整,不满足可追溯要求。
如未记录检验设备编号;未记录样本信息;未记录样本配制过程;未记录原始检测数据。
8.7.1应当建立校准品、参考品量值溯源程序。对每批生产的校准品、参考品进行赋值。
(4)未制定企业参考品、工作校准品量值溯源程序;配制记录与规程不完全一致;配制记录不完整、缺失,不满足可追溯要求。
如未记录赋值用试剂的批号信息、未记录国家参考品稀释度;制备用临床样本无法有效追溯。
3.总结与建议
医疗器械质量体系管理是实现对医疗器械生产全过程控制,保障医疗器械安全有效的重要手段。通过对现场核查常见不符合项的汇总分析,建议企业在日常质量体系运行过程中,应确保各阶段程序受控、分工职责明确、过程完整、内容真实、记录可追溯,落实产品质量主体责任。
|

