一、检查概况
2021-2023年,上海器审中心实施医疗器械注册人委托生产现场检查共计189家,涉及160种医疗器械产品,共开具1055项规范不合格项。其中,2021年核查23家企业,2022年核查49家,2023年核查117家。近年来,医疗器械注册人委托生产数量呈现爆发增长趋势,三年内二类产品数量增长343%,三类产品数量增长557%(图1)。

图1 2021-2023年本市委托生产注册核查数量
在开展委托生产的产品中,无源与植入产品共104种,占比65%,多为有源主机的附件。不同种类的产品委托生产数量也呈现增长趋势,其中有源产品的委托生产数量增长了约2倍,无源与植入产品的委托生产三年间增长了3倍,体外诊断试剂产品三年间实现了“从零到多”的突破(图2)。
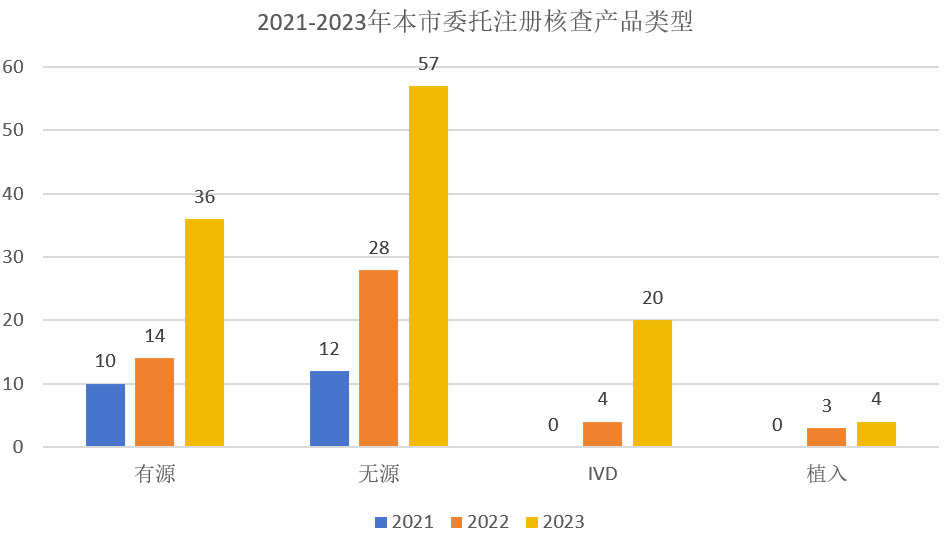
图2 2021-2023年本市委托生产注册核查产品类型
二、受托生产地域分布情况
本市开展的委托生产现场检查分以下两种情况:(1)上海注册人委托外省市生产企业生产(图3);(2)外省市注册人委托上海生产企业生产(图4)。委托生产具有明显的聚集效应,不管是外省注册人还是外省受托生产企业,多集中分布于长三角一带。尤其是有源类产品,外省受托企业一般分布在长三角与广东等电子行业较为发达的地区。
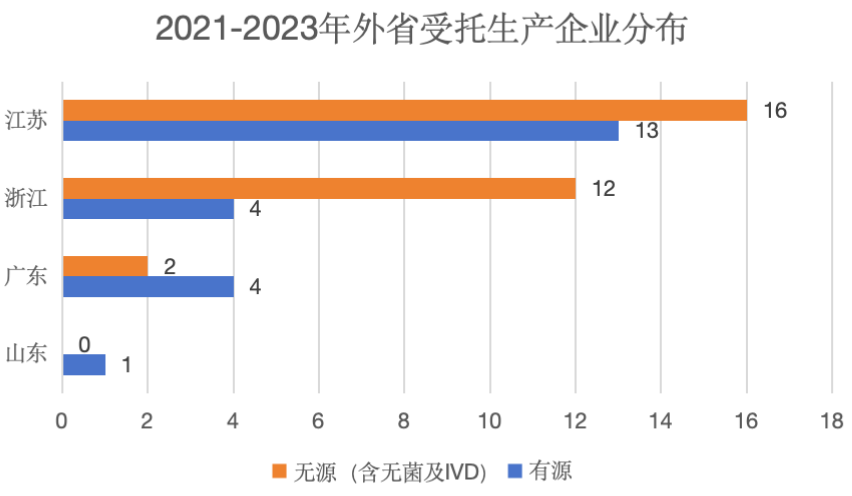
图3 2021-2023年外省受托生产企业分布
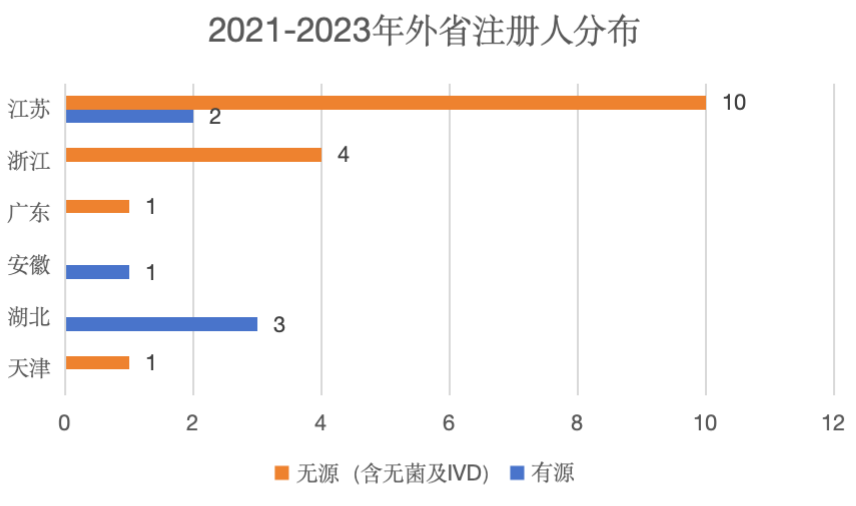
图4 2021-2023年外省注册人分布
三、委托生产现场检查不合格项情况
2021-2023年本市医疗器械注册人委托生产现场核查中共发现不符合项1055条,涉及《医疗器械生产质量管理规范》及附录条款1049条,《上海市医疗器械注册人委托生产质量管理体系实施指南》不符合6条,其中重点项297项(占比28.1%),一般项758项(占比71.8%)。
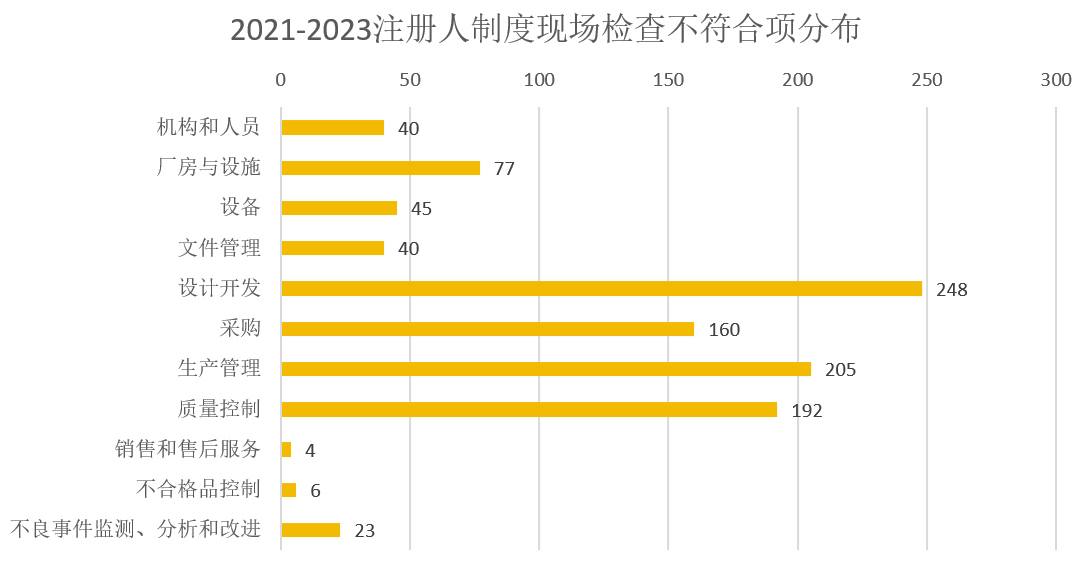
图5 2021-2023年注册人制度现场检查不符合项分布
四、常见不合格项分析
2021年以来,医疗器械注册人委托生产体系现场检查发现,委托生产质量协议主要存在以下方面问题:
(1)委托生产质量协议未明确注册申请人对受托方进行采购控制、生产过程和质量检验能力等方面的监督方式、监控频次和标准。
(2)委托生产质量协议中未对采购、供应商管理(包含供应商变更)等职责进行分工和描述。
(3)委托生产质量协议中,缺少双方在生产、检验等产品实现过程中的分工、职责描述。
(4)委托生产质量协议未区分生产放行和上市放行;
(5)双方签订的委托生产质量协议中,未对投诉、不良事件的处置流程、双方职责做出规定。
结合《医疗器械生产质量管理规范》及其附录,2021年以来注册人受托生产现场检查的不合格项主要集中在设计开发、采购、生产管理与质量控制部分,占比为76.7%。除“上海器审”微信公众号已发布的现场核查共性问题外,注册人委托生产还存在如下问题:
1、设计开发
(1)对于实际由受托企业完成设计开发并将设计转移至注册人的情形,设计转移不充分(如:未将产品图纸、工艺文件、检验等设计文件转移至注册人),或双方未签订设计转移相关协议,或未在文件中规定注册人对设计转移产品的设计控制要求;
(2)注册人未将工艺控制点转移给受托企业,如部分物料在进货时需要进行辐照灭菌,但注册人未对辐照灭菌开展研究,也未在设计文档中体现该流程;
(3)设计输出文件转移不全,如未将作业指导书、使用说明书、标签样张等转移给受托企业,或未保存受托方接收的记录。
2、采购
实际采购、供应商评价等行为与双方签订的委托生产质量协议不符。协议规定A类物料的供应商评价由注册人和受托生产企业共同完成,但实际仅查见受托生产企业的供应商评价记录;协议规定供方变更需由注册人批准,但实际未查见注册人的批准记录;协议规定由受托方开展采购,但采购记录显示采购方不是受托企业等。
3、生产管理
(1)注册人对受托企业的审核评估有效性不足,如现场查见受托企业无菌检测室/微生物限度间/阳性对照间共用同一套净化系统、净化车间部分顶角圆弧带开裂、脱落等问题;
(2)注册人未对受托企业制定的作业指导书进行评审和确认;
(3)产品的灭菌批号与注册人制定的产品编码规则不符。
4、质量控制
(1)受托企业在检验时未按照注册人输出的检验规程开展;
(2)受托企业在生产放行时未对由注册人承担的部分检验项目结果进行确认;
(3)未按照协议要求提供注册人授权受托企业生产放行的授权书,未按照协议的要求开展放行等,与委托生产质量协议不符。
|

